

- 首页
- 关于我们
- 产品中心
- 斑马鱼科研服务
- 斑马鱼基因组遗传实验操作
- 斑马鱼染色及其他技术服务
- 整体斑马鱼原位杂交技术服务
- 斑马鱼免疫荧光技术服务
- 斑马鱼软骨染色技术服务
- 斑马鱼硬骨染色技术服务
- 斑马鱼血红蛋白O-dianisidine染色技术服务
- 斑马鱼中性粒细胞染色技术服务
- 斑马鱼巨噬细胞染色技术服务
- 斑马鱼活性氧(ROS)检测技术服务
- 斑马鱼破骨染色技术服务
- 斑马鱼脂质(油红O)染色技术服务
- 斑马鱼细胞凋亡染色技术服务(AO染色法)
- 斑马鱼初级造血细胞观察技术服务(初级造血细胞荧光转基因鱼)
- 斑马鱼次级造血细胞观察技术服务(次级造血细胞荧光转基因鱼)
- 斑马鱼多巴胺神经元细胞观察技术服务(多巴胺神经元细胞荧光转基因鱼)
- 斑马鱼T细胞观察技术服务(T细胞荧光转基因鱼)
- 斑马鱼B细胞观察技术服务(B细胞荧光转基因鱼)
- 斑马鱼血流速度测定技术服务
- ELISA检测斑马鱼物质含量技术服务
- 组织病理技术服务
- 斑马鱼CRISPANT突变体构建技术服务
- 斑马鱼原位杂交探针(含探针载体构建、合成、验证)
- 斑马鱼细胞凋亡染色技术服务(TUNEL染色法)
- 斑马鱼细胞增殖染色技术服务(Edu染色法)
- 斑马鱼NO染色技术服务(DAF-FM荧光探针)
- 斑马鱼脂质过氧化染色技术服务(DPPP荧光探针)
- 斑马鱼β-半乳糖苷染色技术服务
- 斑马鱼肾小球滤过率技术服务
- 斑马鱼心房心室形态观察技术服务(心脏荧光转基因鱼)
- 斑马鱼中性粒细胞观察技术服务(中性粒细胞荧光转基因鱼)
- 斑马鱼巨噬细胞观察技术服务(巨噬细胞荧光转基因鱼)
- 斑马鱼软骨细胞观察技术服务(软骨细胞荧光转基因鱼)
- 斑马鱼成骨细胞观察技术服务(成骨细胞荧光转基因鱼)
- 斑马鱼毛细胞观察技术服务(毛细胞荧光转基因鱼)
- 斑马鱼肝脏细胞观察技术服务(肝脏细胞荧光转基因鱼)
- 斑马鱼胰腺细胞观察技术服务(胰腺细胞荧光转基因鱼)
- 斑马鱼甲状腺细胞观察技术服务(甲状腺细胞荧光转基因鱼)
- 斑马鱼线粒体观察技术服务(线粒体荧光转基因鱼)
- 斑马鱼突触观察技术服务(突触荧光转基因鱼)
- 斑马鱼行为实验技术服务
- 斑马鱼毒理实验技术服务
- 斑马鱼实验操作试剂盒
- 斑马鱼检测试剂盒(补充)
- 斑马鱼基因敲除试剂盒
- 斑马鱼gRNA合成试剂盒
- 斑马鱼gRNA纯化试剂盒
- 斑马鱼基因组DNA快速提取试剂盒
- PCR产物纯化试剂盒(磁珠法)
- T7酶切试剂盒
- 斑马鱼基因组DNA精确提取试剂盒
- 斑马鱼幼鱼/组织总RNA提取试剂盒
- 斑马鱼破骨染色试剂盒
- 斑马鱼脂质(油红O)染色试剂盒
- 斑马鱼软骨染色试剂盒
- 斑马鱼硬骨染色试剂盒
- 斑马鱼组织特异性标记转基因试剂盒
- 斑马鱼miRNA功能验证转基因试剂盒
- 斑马鱼过量表达转基因试剂盒
- 斑马鱼原位杂交试剂盒
- 斑马鱼血红蛋白O-Dianisidine染色试剂盒
- 斑马鱼凋亡细胞染色试剂盒
- 斑马鱼中性粒细胞染色试剂盒
- 斑马鱼巨噬细胞染色试剂盒
- 斑马鱼活性氧(ROS)检测试剂盒
- 斑马鱼免疫组化试剂盒
- 斑马鱼临床转化应用
- 产品功效及安全性评价
- 斑马鱼实验室建设服务
- 哺乳动物科研服务(啮齿类)
- 科研课题服务
- 细胞与分子实验相关技术服务
- 天然产物的生物活性评价研究
- 其他技术服务
- 斑马鱼科研服务
- 科研相关资源
- 加入我们
编辑:田阳娜
原文地址:https://www.sciencedirect.com/science/article/abs/pii/S0378874120333833?via%3Dihub
前言
1. 斑马鱼作为研究炎症反应的理想体内模型原因
斑马鱼(Danio rerio)具有体积小、繁殖率高、生长迅速和易于维护的特点,是模拟人类疾病和筛选有效药物的理想体内工具,吸引了相当大的吸引力。特别是大量的研究表明,斑马鱼的先天免疫系统和获得性免疫系统与人类极其相似。斑马鱼体内已鉴定出中性粒细胞、巨噬细胞和淋巴细胞等免疫细胞,以及IL-6、TNF-α、NF-κB等大量炎症基因,因此斑马鱼已被充分验证为研究炎症反应的理想体内模型。此外,斑马鱼的全透明体和转基因荧光报告系的产生使得在整个炎症过程中无创、动态地观察和跟踪白细胞趋化性成为可能,这是其他脊椎动物无法实现的。
2. 斑马鱼炎症模型建立
脂多糖(Lipopolysaccharide, LPS)又称内毒素,是一种存在于革兰氏阴性菌外膜的糖缀合物。它可以作用于宿主细胞,在细菌死亡时直接或间接地触发病理生理过程。特别是,循环中LPS浓度的升高可诱发全体性炎症反应综合征,其特征是巨噬细胞分泌过多的促炎细胞因子,甚至导致组织和血管损伤。因此,LPS已成为最常见的炎症模型。由于斑马鱼具有体积小、繁殖力强、光学透明、维护成本低、实验周期短以及与哺乳动物特别是人类高度同源性等独特优点,在过去十年中,斑马鱼已成为一种流行的人类疾病模型和药物发现工具。斑马鱼疾病模型广泛应用于生命科学的各个领域,如免疫学、肿瘤学、神经科学等。尤其值得注意的是,斑马鱼具有与人类相似的免疫系统结构,被认为是寻找抗炎新药的理想炎症模型。除LPS外,其他常用的建立斑马鱼炎症模型的诱导剂包括CuSO4、tail横截、Poly IC、二氧化硅纳米颗粒等。
3. 引出语
生脉饮(SMY)是一种著名的中药配方,在中国被广泛使用了几个世纪,用于治疗各种疾病,如炎症相关疾病。然而,SMY的抗炎活性及其潜在机制尚不清楚。在本研究中,旨在确定SMY对RAW 264.7细胞和斑马鱼的抗炎作用,并探讨其潜在机制。
体外实验的第一部分通过首先测定了lps诱导的RAW 264.7小鼠巨噬细胞中促炎因子IL-6和TNF-α的水平。SMY可显著降低IL-6和TNF-α的分泌,提示SMY具有体外抗炎作用。NF-κB是调控炎症发生和发展的最经典途径之一。一旦激活,NF-κB p65亚基与抑制亚基i -κB结合释放,随后易位到细胞核中参与多个靶基因的转录,最终导致促炎因子的释放。此外,大量研究证实,活化的STAT3从细胞质易位到细胞核,并驱动编码促炎介质的靶基因的表达,这表明STAT3在介导炎症级联反应中的重要性。更有趣的是,活化的NF-κB通路可产生炎症因子IL-6直接刺激STAT3信号,活化的STAT3可通过促进其核保留进一步提高NF-κB活性。体外研究表明,五味子甲素A和人参皂苷Rk1是SMY中的两种成分,可以通过阻断NF-κB和STAT3信号通路的激活来缓解炎症。因此,第二部分测试SMY是否通过NF-κB和STAT3通路发挥其抗炎作用。重要的是,在lps刺激的巨噬细胞中,SMY显著抑制了i -κB α和STAT3的磷酸化,并减少了NF-κB p65从细胞质到细胞核的易位,提示SMY部分抗炎活性可能与抑制NF-κB和STAT3激活有关。
体内实验的第一部分观察了中性粒细胞在CuSO4和尾断诱导炎症模型中的行为,以证实SMY的体内抗炎作用。结果表明,SMY明显减少位于受损神经肥大或尾部的中性粒细胞,提示其治疗炎症相关疾病的潜力。第二部分进一步研究SMY的体内抗炎机制,检测了lps刺激斑马鱼中IL-6、TNF-α、NF-κB p65、i -κB α和STAT3的基因表达。与体外实验结果一致,SMY通过抑制NF-κB和STAT3信号通路的激活发挥抗炎作用。
正文
1. 体外第一部分


首先采用MTT法鉴定SMY对RAW 264.7巨噬细胞的无毒剂量。3-[4,5-二甲基噻唑-2-酰基]-2,5-二苯基四唑溴化物即(MTT)法被广泛用于检测细胞活力。简单地说,将细胞以5×103个细胞/孔的密度接种于96孔板中,在37℃下培养过夜。然后用不同浓度的SMY(3.125、6.25、12.5、25、50、100、200、400和800 μg/mL)处理细胞24 h,再用30μL MTT (5 mg/mL)孵育4 h,抽吸上清,加入100 μL DMSO溶解甲酰胺晶体。490 nm处的吸光度用微孔板读取仪读取。结果表明,SMY在100-400 μg/mL浓度下无细胞毒性,用于进一步的实验(图2)。
促炎细胞因子,如IL-6和TNF-α,在炎症的发生和传播中发挥关键作用。因此,我们通过ELISA试剂盒检测了lps诱导的RAW 264.7巨噬细胞中IL-6和TNF-α的蛋白水平。采用ELISA试剂盒检测细胞上清液中IL-6和TNF-α的蛋白水平,如前所述。简单地说,用指定浓度的SMY预处理细胞2小时,然后用LPS (100 ng/mL)刺激24小时。之后,根据制造商的说明测定IL-6和TNF-α的产量。如图3所示,SMY能有效抑制IL-6和TNF-α的释放,表明SMY通过抑制促炎细胞因子的分泌在体外具有显著的抗炎作用。
2. 体外第二部分
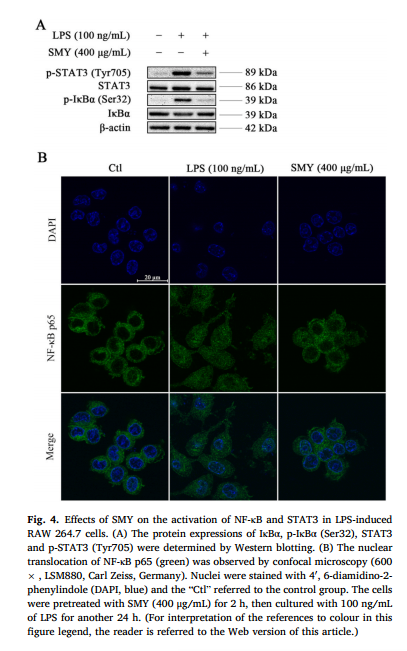
为了进一步阐明SMY抗炎作用的机制,分别采用Western blot和共聚焦显微镜技术检测lps诱导的RAW 264.7细胞中i -κB α、p -κB α (Ser32)、STAT3和p-STAT3 (Tyr705)蛋白水平和NF-κB p65核易位。RAW 264.7细胞分别以5 × 105的密度在60 mm培养皿中或以1 × 105 /孔的共聚焦培养皿中接种24 h。然后用SMY (400 μg/mL)预处理2 h,再与LPS (100 ng/mL)共孵育24 h。Western blotting检测i - κ b α、p- κ b α (Ser32)、STAT3和p-STAT3 (Tyr705)的表达。用共聚焦显微镜检测NF-κB p65的核易位。Western blotting数据显示,LPS在RAW 264.7巨噬细胞中诱导i - κ b α Ser32位点和STAT3 Tyr705位点磷酸化,而SMY处理后这些现象明显被阻止(图4A)。此外,在lps刺激的RAW 264.7细胞中,NF-κB p65易位到细胞核中。SMY处理后,NF-κB p65主要分布在细胞质中(图4B)。综上所述,这些发现表明SMY减弱了lps诱导的NF-κB和STAT3的激活。
3. 体内第一部分

为检测SMY对斑马鱼的毒性潜势,每天监测不同浓度SMY处理后斑马鱼幼鱼的形态变化和死亡率。在中性粒细胞中表达绿色荧光蛋白的转基因斑马鱼Tg(MPO:GFP) (Renshaw et al ., 2006)在盐度为0.03%-0.04%的循环水生境系统中,以14 h光照/10 h暗光照周期培养。将受精后第1天的斑马鱼胚胎随机分为24孔板(n = 20),然后浸泡在不同浓度的SMY (0 ~ 250 μg/mL)中。每天更换培养基。记录死胚,每隔24 h取出一次,直至第6天。如图5所示,选择存活率大于95%的浓度(12.5 ~ 50 μg/mL)作为无毒剂量进行后续使用。

为了观察SMY在体内的防御作用,我们将LPS (2 nL)微注射到3dpf幼鱼的卵黄囊中,诱导其致死性炎症。随后,将这些幼虫随机分为24孔板(n = 20/孔),分别用不同浓度的SMY(12.5、25、50 μg/mL)浸泡。微量注射PBS (2 nL)作为对照,阳性药物为Dex (5 μg/mL) 。12 h后,在荧光显微镜下拍摄幼鱼,观察荧光中性粒细胞的行为,并取样进行存活分析。结果表明SMY可以提高lps刺激的斑马鱼的存活率,最大可提高40%,这一趋势与Dex治疗相似(图6)。

炎症细胞向炎症部位浸润是炎症反应发生过程中的关键事件,因此采用H&E染色观察幼虫的组织病理学变化。简单地说,将12 hpi的幼鱼转移到1.5 mL无菌管中,用PBS洗涤两次,然后在4% 多聚甲醛中固定过夜。将固定的幼虫在升序乙醇中脱水,在分级二甲苯中透明,然后包埋石蜡。然后制备4 μm厚的载玻片,进行H&E染色,在光学显微镜下观察卵黄囊的病理变化。结果显示,在LPS刺激的斑马鱼中,许多炎症细胞浸润到卵黄囊中,而这些浸润被SMY处理抑制(图7),这进一步表明SMY可以保护LPS刺激的斑马鱼。

中性粒细胞是先天免疫防御病原体的第一道防线,在炎症反应的进展和消除中发挥着至关重要的作用,而中性粒细胞向炎症部位的迁移是炎症的最重要特征之一。在这里,研究了SMY是否在体内调节中性粒细胞的募集。将在中性粒细胞上表达绿色荧光蛋白的转基因斑马鱼Tg (MPO:GFP)应用于lps刺激的炎症模型。接下来,为了证实SMY、CuSO4和尾巴横断诱导的炎症模型对中性粒细胞的调节作用,我们在3只dpf斑马鱼幼鱼中构建了化学或物理损伤侧线神经肥大或尾巴以刺激炎症反应的模型。将3dpf斑马鱼幼鱼随机置于24孔板(n = 20/孔)中,在不同浓度SMY存在或不存在的情况下暴露于20 μM的CuSO4中2 h,以Dex (5 μg/mL)为阳性对照,在荧光显微镜下观察中性粒细胞的募集情况。采用SZX7立体显微镜(Olympus, Tokyo, Japan)对3dpf斑马鱼幼鱼进行麻醉,用手术刀切尾损伤,然后用不同浓度的SMY(12.5、25、50 μg/mL)或Dex (5 μg/mL)浸泡6 h,在荧光显微镜下观察损伤尾部募集的荧光中性粒细胞。结果表明,与未处理的幼虫相比,CuSO4攻击或截尾均明显增加了伤区中性粒细胞的数量。然而,用50 μg/mL的SMY处理导致中性粒细胞募集的急剧减少(图8),提示SMY在体内具有抗炎作用。对照组中性粒细胞分布于腹主动脉区。而中性粒细胞在LPS的作用下明显被招募到幼虫的卵黄囊中。有趣的是,这种招募被SMY剂量依赖性地显著抑制,这意味着SMY治疗抑制了炎症反应(图8)。
4. 体内实验第二部分


为了阐明SMY在体内发挥抗炎作用的原因,首先通过qRT-PCR分析确定了SMY对lps刺激的斑马鱼促炎细胞因子IL-6和TNF-α表达的影响。结果显示,SMY在体内有统计学意义上抑制IL-6和TNF-α的释放(图9)。要进一步探索NF-κB和STAT3是否参与SMY体内抗炎作用,检测其基因表达水平。研究发现,SMY可有效抑制lps诱导的斑马鱼NF-κB p65、i -κB α和STAT3的上调(图10),表明SMY调节IL-6和TNF-α表达的抗炎活性至少部分是通过抑制lps刺激的斑马鱼NF-κB和STAT3信号的激活来介导的。

结语:综上所述,研究首次证明了SMY在体外(RAW 264.7巨噬细胞)和体内(斑马鱼幼鱼)均具有显著的抗炎特性。我们进一步阐明了SMY可能抑制NF-κB和STAT3通路的激活,从而减弱促炎细胞因子的表达的潜在机制(图11)。总之,这些发现为SMY治疗炎症相关疾病的临床应用提供了证据,并支持斑马鱼在炎症中的关键作用。


