

- 首页
- 关于我们
- 产品中心
- 斑马鱼科研服务
- 斑马鱼基因组遗传实验操作
- 斑马鱼染色及其他技术服务
- 整体斑马鱼原位杂交技术服务
- 斑马鱼免疫荧光技术服务
- 斑马鱼软骨染色技术服务
- 斑马鱼硬骨染色技术服务
- 斑马鱼血红蛋白O-dianisidine染色技术服务
- 斑马鱼中性粒细胞染色技术服务
- 斑马鱼巨噬细胞染色技术服务
- 斑马鱼活性氧(ROS)检测技术服务
- 斑马鱼破骨染色技术服务
- 斑马鱼脂质(油红O)染色技术服务
- 斑马鱼细胞凋亡染色技术服务(AO染色法)
- 斑马鱼初级造血细胞观察技术服务(初级造血细胞荧光转基因鱼)
- 斑马鱼次级造血细胞观察技术服务(次级造血细胞荧光转基因鱼)
- 斑马鱼多巴胺神经元细胞观察技术服务(多巴胺神经元细胞荧光转基因鱼)
- 斑马鱼T细胞观察技术服务(T细胞荧光转基因鱼)
- 斑马鱼B细胞观察技术服务(B细胞荧光转基因鱼)
- 斑马鱼血流速度测定技术服务
- ELISA检测斑马鱼物质含量技术服务
- 组织病理技术服务
- 斑马鱼CRISPANT突变体构建技术服务
- 斑马鱼原位杂交探针(含探针载体构建、合成、验证)
- 斑马鱼细胞凋亡染色技术服务(TUNEL染色法)
- 斑马鱼细胞增殖染色技术服务(Edu染色法)
- 斑马鱼NO染色技术服务(DAF-FM荧光探针)
- 斑马鱼脂质过氧化染色技术服务(DPPP荧光探针)
- 斑马鱼β-半乳糖苷染色技术服务
- 斑马鱼肾小球滤过率技术服务
- 斑马鱼心房心室形态观察技术服务(心脏荧光转基因鱼)
- 斑马鱼中性粒细胞观察技术服务(中性粒细胞荧光转基因鱼)
- 斑马鱼巨噬细胞观察技术服务(巨噬细胞荧光转基因鱼)
- 斑马鱼软骨细胞观察技术服务(软骨细胞荧光转基因鱼)
- 斑马鱼成骨细胞观察技术服务(成骨细胞荧光转基因鱼)
- 斑马鱼毛细胞观察技术服务(毛细胞荧光转基因鱼)
- 斑马鱼肝脏细胞观察技术服务(肝脏细胞荧光转基因鱼)
- 斑马鱼胰腺细胞观察技术服务(胰腺细胞荧光转基因鱼)
- 斑马鱼甲状腺细胞观察技术服务(甲状腺细胞荧光转基因鱼)
- 斑马鱼线粒体观察技术服务(线粒体荧光转基因鱼)
- 斑马鱼突触观察技术服务(突触荧光转基因鱼)
- 斑马鱼行为实验技术服务
- 斑马鱼毒理实验技术服务
- 斑马鱼实验操作试剂盒
- 斑马鱼检测试剂盒(补充)
- 斑马鱼基因敲除试剂盒
- 斑马鱼gRNA合成试剂盒
- 斑马鱼gRNA纯化试剂盒
- 斑马鱼基因组DNA快速提取试剂盒
- PCR产物纯化试剂盒(磁珠法)
- T7酶切试剂盒
- 斑马鱼基因组DNA精确提取试剂盒
- 斑马鱼幼鱼/组织总RNA提取试剂盒
- 斑马鱼破骨染色试剂盒
- 斑马鱼脂质(油红O)染色试剂盒
- 斑马鱼软骨染色试剂盒
- 斑马鱼硬骨染色试剂盒
- 斑马鱼组织特异性标记转基因试剂盒
- 斑马鱼miRNA功能验证转基因试剂盒
- 斑马鱼过量表达转基因试剂盒
- 斑马鱼原位杂交试剂盒
- 斑马鱼血红蛋白O-Dianisidine染色试剂盒
- 斑马鱼凋亡细胞染色试剂盒
- 斑马鱼中性粒细胞染色试剂盒
- 斑马鱼巨噬细胞染色试剂盒
- 斑马鱼活性氧(ROS)检测试剂盒
- 斑马鱼免疫组化试剂盒
- 斑马鱼临床转化应用
- 产品功效及安全性评价
- 斑马鱼实验室建设服务
- 哺乳动物科研服务(啮齿类)
- 科研课题服务
- 细胞与分子实验相关技术服务
- 天然产物的生物活性评价研究
- 其他技术服务
- 斑马鱼科研服务
- 科研相关资源
- 加入我们
杂志:Journal of Experimental & Clinical Cancer Research
影响因子: 11.3(2022)
年份:2017
通讯作者: Ming-Fang He
通讯作者单位:Institute of Translational Medicine, College of Biotechnology and Pharmaceutical Engineering, Nanjing Tech University
摘要:
背景: 胃癌(GC)是亚洲最常见的、尤其是在中国高发的癌症之一。由于其高异质性和很少的已验证的药物靶点,GC仍然是精确医学中最缺乏探索的领域之一。在这项研究中,我们的目的是建立一个基于斑马鱼(Danio rerio)胚胎的体内患者来源的异种移植物(PDX)模型,快速分析GC对血管生成影响和癌症侵袭性的能力,以及快速的药物敏感性测试。
方法:将两种人胃癌细胞系(AGS和SGC-7901)异种移植到斑马鱼胚胎中,并在体外和体内检测了它们对5-FU的敏感性。将14个来自胃癌组织的人原代细胞移植到斑马鱼胚胎中,并在体内评估了它们的增殖、血管生成和转移活性。对4例患者的主要样本也检测了对5-FU、多西他赛和阿帕替尼的敏感性。
结果:SGC-7901在体外和体内对5-FU的敏感性均高于AGS。14个患者样本中有9个被成功移植到斑马鱼胚胎中,所有这些样本在活胚胎中均显示出增殖、血管生成和转移潜能。4例患者对所选三种化疗药物的敏感性不同。
结论:我们的斑马鱼PDX(zPDX)模型是一种临床前可靠的胃癌体内模型。zPDX模型也是胃癌的转化研究和个性化治疗的理想平台。
关键词:胃癌,斑马鱼,患者来源的异种移植物,显微注射,转化研究
前言
胃癌(GC)仍然是全球范围内的一个主要的健康负担。根据国际癌症研究机构(IARC)2012年的统计数据,胃癌是全球第五大最常见的恶性肿瘤,也是第三大癌症死亡原因。70%以上的病例发生在发展中国家,其中一半的世界总病例发生在东亚(主要发生在中国)。根据中国国家癌症预防控制办公室统计,GC分别是男性和女性中第二和第三位,是男女癌症死亡的第二大原因。
在中国,近90%的患者被诊断为晚期胃癌。虽然近年来靶向药物的加入在一定程度上改善了预后,但基于含氟尿嘧啶化疗的综合治疗仍是晚期胃癌的主要策略。晚期的GC患者的中位生存率仍不到12个月,整体5年生存率低至只有20%。 造成这些的原因是由于胃癌的化学敏感性或化疗耐药性造成的高异质性质和其他未知机制。因此,新药的开发以及当前药物的个性化治疗策略的建立成为主要挑战。
近年来,患者来源的异种移植(PDX)模型越来越流行,比细胞系来源的异种移植(CDX)模型具有更大的优势。它紧密地再现了患者原发肿瘤的异质性,并具有基因表达和突变状态的生物学稳定性。越来越多的证据表明,PDX模型通过直接比较患者及其相应的异种移植物的药物反应,忠实地再现了患者的肿瘤生物学,并预测了患者的药物反应。目前,大多数PDX模型都是通过将患者的肿瘤组织皮下移植到NOD/SCID(非肥胖糖尿病/严重联合免疫缺陷)小鼠中而建立的。目前已经建立了各种肿瘤的小鼠PDX模型,包括结直肠癌、乳腺癌]、非小细胞肺癌、肾细胞癌和胃癌,用于肿瘤生物学和药物筛选的研究。然而,相关的成本是巨大的,而且完成这些研究所需的时间可能是广泛的,并且与在可操作的时间框架内的患者导向干预不兼容。
斑马鱼(Danio rerio)是一种强大的、基因可控的人类恶性肿瘤研究模型。它显示了与哺乳动物高度的生理和遗传相似性,接近临床环境,并允许肿瘤的自然生长监测。由于其胚胎具有明显透明的特点,可在体内便捷地管子肿瘤的发展、血管生成、侵袭和转移,使其成为一种很有前途的异种移植肿瘤模型。近年来,斑马鱼PDX(zPDX)模型的价值刚刚出现了。
本文的目的是描述一种新的GC的体内zPDX模型。该模型可用于以节省时间和成本的研究肿瘤血管生成、细胞侵袭性和药物反应。重要的是,这项工作揭示了zPDX模型,作为第一个个性化GC治疗的实时体内平台。
方法
试剂
5-氟尿嘧啶(5-FU,纯度≥98%)购买自西格玛奥尔德里奇(美国圣卢里斯)和溶解在胚胎培养基或细胞培养基获得母液5M浓度。多西他赛(纯度≥98%)和阿帕替尼(纯度≥98%)购买自MERYER(中国上海)和溶解在DMSO获得母液浓度分别为5mM和500 μM。胎牛血清(FBS)、磷酸盐缓冲盐水(PBS)、罗斯威尔帕克纪念研究所基础培养基1640(RPMI 1640)、青霉素和链霉素均购自基础培养基技术公司(上海,中国)。
斑马鱼的养殖和处理
在内皮细胞中表达增强绿色荧光蛋白(EGFP)的转基因斑马鱼Tg(fli-1:EGFP)来自南京大学模型动物研究中心。它们被养殖在28.5°C。光-暗周期为14:10小时。胚胎是将2只雄性和2只雌性混合在配有网格的水箱中,以避免对新产卵的捕食。鱼在光照的刺激下进行交配和产卵。收集胚胎,以28.5°C放置于含有胚胎培养基(0.2 g/L蒸馏水中速溶海洋®Salt)的培养皿中。胚胎的年龄以受精后数小时(hpf)表示。对斑马鱼的研究得到了南京科技大学动物护理和使用委员会(IACUC)的批准。
细胞系培养和原代组织分离
GC细胞系AGS和SGC-7901(ATCC,Rockville,MD,USA)在RPMI 1640中添加10%胎牛血清和100 U/mL青霉素和链霉素。2016年9月至2017年8月,胃癌样本经南京医科大学患者知情同意和机构伦理委员会批准后,来自南京医科大学第一附属医院普外科胃肠外科(注册人数10,092例)。包含人类受试者的研究是根据《世界医学协会道德守则》(《赫尔辛基宣言》)进行的。所有患者在手术切除前均未接受放疗或化疗。切除后,组织样本直接转移到预冷的组织存储溶液(米特尼,贝吉施格拉德巴赫,德国)。根据制造商的说明,通过肿瘤分离试剂盒(德国贝尔吉施格拉德巴赫)从组织样本中分离原代单细胞。
体外细胞活力试验
使用细胞计数试剂盒-8(CCK-8,Dojindo,日本)测定细胞活力。将对数期的细胞接种于96孔板(3×103细胞/孔),过夜培养后,将培养基替换为含有指定浓度的5-FU的新鲜培养基(150μl/孔),培养72小时。用培养基处理过的细胞作为载体对照。随后,每孔加入10 μl CCK8溶液,细胞孵育2h后, 使用酶标仪(BioTek,维诺斯基,VT,美国)测量在450 nm处吸光度。对照组的吸光度被视为100%的细胞活力。结果以吸光度形式的抑制百分比表示。采用GraphPad Prism 5.0分析50%抑制浓度(半抑制浓度)。所有实验均重复3次,独立实验至少重复4次。
细胞标记,异种移植和计数过程
细胞系AGS和SGC-7901和原代GC细胞根据制造商的说明用CM-DiI(Invitrogen,生命技术公司,卡尔斯巴德,CA,美国)进行荧光标记。标记细胞用PBS洗涤两次,在添加10%胎牛血清的RPMI1640中重新悬浮,浓度为2×107个细胞/ml。注射前用台盼蓝染色法检测细胞活力。GC细胞系的细胞活力高于95%,原代GC细胞的细胞活力高于70%。
转基因斑马鱼胚胎Tg(fli-1: EGFP)用1 mg/ml的旋膜酶(Sigma-奥尔德里奇,圣卢里斯,密苏里州,美国)脱毛。去除绒毛膜后,将胚胎浸泡在含有0.2mm1-苯基2-硫脲(PTU)的胚胎培养基中,在28.5°C下再孵育24 h。在48 hpf时,胚胎用0.0003%三卡因(西格玛-奥尔德里奇,美国密苏里州)麻醉,并将其右侧向上放置在湿琼脂糖垫上。使用立体镜观察的显微注射器(SMZ 745 T,尼康,日本)将约200-300个细胞和约600-800个原代细胞作为患者样本注射到每个斑马鱼胚胎的卵黄囊中。移植后,胚胎在28.5°C下孵育1小时,检查卵黄囊中是否有细胞,以及循环系统中是否没有细胞。然后将胚胎在32°C下孵育接下来的几天。一组10个胚胎被处死,分离成单细胞悬液,以cm-dii标记的细胞数量为载体或药物治疗前GC细胞的基线数,以确保细胞在斑马鱼胚胎中移植和增殖。为了确认在指定时间点的人类癌细胞的计数,并排除组织碎片的非特异性染色,与10 nM DRAQ5共染色(生物状态有限公司。英国莱切斯特)使用了核染色剂。一个示意图显示了细胞注射和药物治疗的时间线(图1)。

Fig.1斑马鱼体内异种移植和药物治疗示意图。Hpf:受精后数小时,注射后天数,dpi:治疗后天数
通过浸泡和微注射到异种移植模型给药
药物通过浸泡的方式, 处理斑马鱼。 异种移植斑马鱼胚胎在72 hpf随机转移到24孔板,10胚胎每孔0.5毫升的胚胎介质含有不同浓度的药物(多西紫杉醇和阿帕替尼)处理48 h的48 h。用0.1% DMSO处理过的斑马鱼胚胎作为载体对照。处理实验在恒温(32°C)的黑暗环境下进行。用胚胎培养基将卵黄囊(5-FU)稀释至适当浓度进行卵黄囊微注射。在显微注射前,72 hpf的斑马鱼胚胎用0.0003%三卡因(西格玛-奥德里奇,圣卢里斯,美国)麻醉,右侧放置在湿琼脂糖垫上。使用微注射器(IM-31,日本)将指定浓度的10 nl药物注入卵黄囊,同时通过立体镜(SMZ 745 T,尼康,日本)进行观察。将注射后的胚胎随机移植到24孔板上,每孔10个胚胎,加入0.5 ml胚胎培养基,处理时间为48 h。斑马鱼胚胎使用微注射器(IM-31,日本)将注射10 nl指定浓度的药物注入每个斑马鱼胚胎的卵黄囊,同时通过立体镜观察(SMZ 745 T,尼康,日本)。将注射后的胚胎随机移植到24孔板上,每孔10个胚胎,加入0.5 ml胚胎培养基,处理时间为48 h。斑马鱼胚胎注射10 nl胚胎培养基作为载体对照。图1显示了细胞注射和药物治疗的时间线。为了观察血管生成,异种移植胚胎用50 nM VRI浸泡6 hpi,32°C孵育。照片以72 hpf拍摄。
图像采集
我们通过倒置荧光显微镜(IX71,奥林巴斯,日本)在注射后1、4、7天(dpi)监测肿瘤细胞的生长和迁移。用共聚焦显微镜(LSM710,蔡司,德国)观察血管生成。如果标记的胃细胞在卵黄囊区域外(在头部、躯干和/或尾部)被识别出来,我们认为这是主动迁移。
免疫组化方法
胚胎注射细胞(7 dpi)在4%多聚甲醛中固定,脱水,石蜡包埋,切片(6-8μm)。切片用苏木精和伊红染色。图像通过倒置荧光显微镜(IX71,奥林巴斯,日本)获得。
统计分析
所有统计分析均采用GraphPad Prism 5.0以平均± SEM表示。采用单因素方差分析分析变化的减少/增加,然后采用Dunnett多重比较检验。当P值低于0.05时,考虑有显著性差异。(***)表示P < 0.005,(**)P < 0.01,(*)P < 0.05均有统计学意义。所有实验均重复3次,独立实验至少重复3次。
结果
细胞系AGS和SGC-7901诱导了斑马鱼胚胎的血管生成
在从2 dpf到3 dpf的时间范围内,斑马鱼胚胎完整的肠下血管(SIVs)形成了篮子,看起来像一个篮子(图2a)。注射的细胞系AGS(图2b)和SGC-7901(图2c)早在注射后1天(dpi)的斑马鱼胚胎中就表现出促血管生成行为,胚胎的SIVs形成额外的分支,并向肿瘤植入物发芽(图2b,c)。VRI是一种吡啶基氨基苯胺酰胺化合物,对VEGFR-1和2的激酶活性均有强烈的抑制作用,可以阻断AGS(图2d)和SGC-7901(图2e)诱导的血管生成。
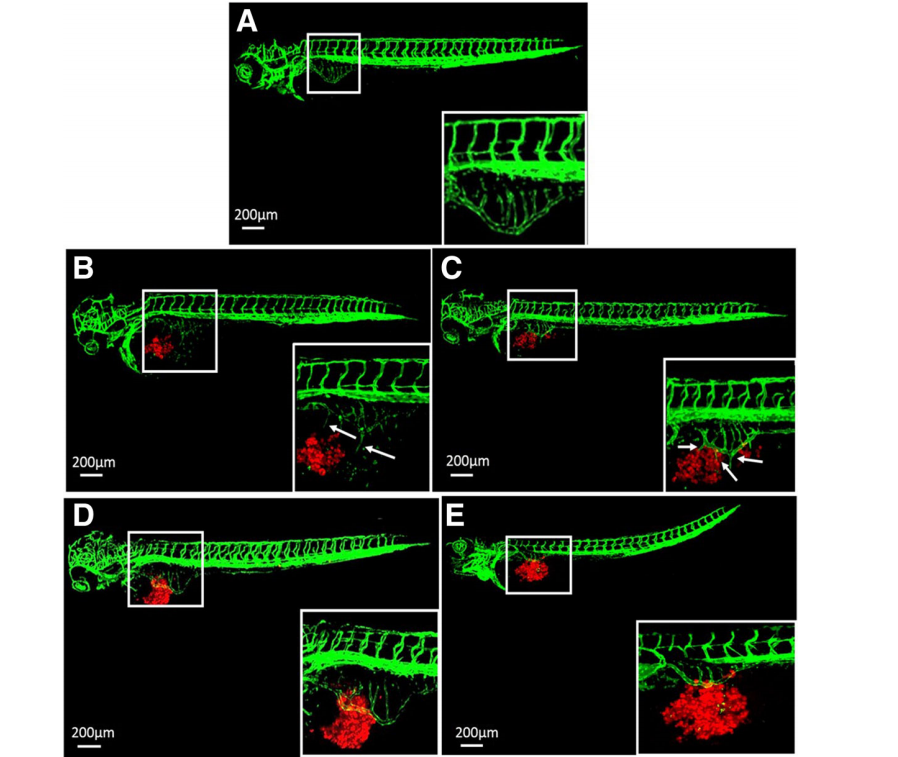
Fig.2胃癌细胞在斑马鱼幼鱼(fli-eGFP)中存活并诱导血管生成。A在3 dpf时未注射胚胎的肠下血管的典型图像。将AGS细胞(B)和SGC-7901细胞(B)注射到斑马鱼胚胎中,并在1 dpi时诱导血管生成。50 nM VRI可阻断AGS (D)和SGC-7901细胞系引起的肠下血管生成(E)。右下角的白色盒子显示了左上角的白色盒子的更高的放大倍数。箭头表示肿瘤细胞诱导的血管生成。Hpf:受精后数小时;dpi:注射后天数.
细胞系SGC-7901在体内和体外对5-FU的敏感性均高于AGS
在体外化学敏感性试验中,5-FU以剂量依赖的方式对两种细胞的细胞活力产生了显著的抑制作用。在72h的孵育时间下,AGS和SGC-7901的半抑制浓度分别为10.5 ± 1.8 μM和6.3±0.9μM(表1)。

其中SGC-7901在体外对5-FU处理的敏感性高于AGS。我们的结果与前面的报告一致,即AGS对5-FU治疗相对于SGC-7901的耐药性。然后,将AGS和SGC-7901细胞分别移植到48 hpf的斑马鱼胚胎中。在72 hpf时,50-4000μM的5-FU浸泡给胚胎。令我们惊讶的是,这些浓度都没有抑制肿瘤生长,也没有在治疗后2天对胚胎发育产生任何不良影响。然后我们尝试了显微注射给药。5-FU的最大耐受剂量(MTD)被确定为65ng/胚胎。将0 dpt时的细胞数设置为基线,并归一化为1。在2 dpt时,对照组SGC-7901细胞增殖1.8倍,而5-FU处理组6.5和65ng/胚胎分别增殖1.2倍和1倍(图3a)。对照组在2 dpt时AGS细胞增殖1.8倍,而5-FU处理组在6.5ng和65ng/胚胎时AGS细胞分别增殖1.9倍和1.7倍(图3b)。SGC-7901与AGS相比,SGC-7901对5-FU治疗具有更高的敏感性。

Fig, 5-FU不同治疗组在2 dpt时,斑马鱼异种移植模型中胃细胞系的增殖情况。将AGS细胞系(a)和SGC-7901细胞系(b)的200-300细胞荧光标记,在48 hpf(0 dpi)微注射到每个斑马鱼胚胎的卵黄囊。24 h(0 dpt)后,斑马鱼胚胎分别微注射载体对照(0.1% DMSO)、6.5ng/胚胎和65ng/胚胎的5-FU,持续2天。在0 dpt和2 dpt时分别牺牲胚胎来测定细胞数量。0 dpt时的细胞数归一化为1,并设置为基线。定量值为来自30个独立个体的平均±扫描电镜。当P值低于0.05时,考虑不同治疗组的显著性差异。(***)表示P < 0.001. hpf:受精后小时,dpi:注射后天,dpt:治疗后天数有统计学意义
患者来源的胃癌样本形成腺样结构,诱导血管生成并呈现转移特征
在PDX水平(7 dpi)的横组织学切片中,GC组织的原代细胞在zPDX模型中也形成了腺样结构,通常保留其原始特征(图4)。

Fig. 4 7dpi时zPDX模型的苏木精和伊红(H & E)染色。具有代表性的zPDX的(a)和(b)放大倍数较高。(A)中的黑框表示缩放区域。(A)中的箭头和(B)中的黄色虚线指向胃癌患者原代上皮细胞形成的腺样结构。Dpi:注射后天数
来自GC组织的原代细胞在1 dpi时诱导血管生成。斑马鱼的血管系统进入异种移植的肿瘤肿块(图5a)。红色标记的GC组织的原代细胞在1 dpi时没有侵袭(图5b),但在4dpi(图5c)和7dpi(图5d)时,在发育中的胚胎中表现出渐进和广泛的扩散,并向脑、躯干和尾部转移。大脑的血管系统密度很高。肿瘤细胞几乎在大脑中具有单细胞分辨率(图5e)。肿瘤细胞也分布在尾侧造血组织(CHT)区域(图5f),这是肿瘤细胞从血管中渗出并侵袭邻近组织的“热点”区域。

Fig. 5来自GC组织的原代细胞诱导了斑马鱼幼鱼的血管生成和转移(flii-eGFP)。将患者样本的600-800个原代细胞荧光标记,并在48 hpf(0 dpi)微注射到每个斑马鱼胚胎的卵黄囊中。在斑马鱼PDX模型中,来自GC组织的原代细胞在1 dpi (a)时诱导血管生成,并在1 dpi (b)、4 dpi (c)和7 dpi (d)时表现出侵袭行为。在7 dpi时,我们可以检测到大脑(e)和尾侧造血组织(CHT)区域(f)中的癌细胞。(a)中的箭头指向肿瘤肿块内的肿瘤诱导的新血管。(c)-(f)中的箭头指向斑马鱼胚胎的头部、躯干和尾部转移的肿瘤细胞。Hpf:受精后数小时,dpi:注射后几天。
64%的胃癌患者样本显示移植成功
对14例患者进行了原发性胃癌细胞异种移植术。表2总结了其临床和组织病理学特征。14个原发GC细胞中有9个成功移植到斑马鱼胚胎中,而在5例中,异种移植没有成功,因为粘性结构不能分离成单细胞,导致随后的针堵塞。在9个成功的斑马鱼PDX模型中,所有9个原发性胃癌样本都在发育中的斑马鱼胚胎中显示出活跃的迁移细胞。

斑马鱼PDX模型的临床前药物敏感性研究
在临床上,胃癌的主要治疗方法是手术切。然而,70-80%的淋巴结转移患者会复发并死于疾病。术后辅助治疗中的化疗包括5-FU和多西他赛已被证明可以延长生存期和提高高质量的生活]。Apatinib是一种新型的受体酪氨酸激酶抑制剂,可选择性地靶向血管内皮生长因子受体2(VEGFR-2)的细胞内atp结合位点。它是一种口服生物可利用药物,目前正在几种实体肿瘤中研究,在胃癌中显示出良好的活性。2014年被中国SFDA批准用于治疗进展期胃癌。我们接下来进行了评估该模型是否可用于评估抗GC药物,如5-FU、多西紫杉醇和阿帕替尼的疗效。我们从4例胃癌患者(患者#6-#9)中选择了斑马鱼PDX模型,其中患者#6和#7于2017年1月被诊断为胃癌并接受了治疗性手术,而患者#8和#9在2017年8月刚刚接受了治疗性手术。4例患者术后均接受5-FU辅助治疗。6号和7号患者的斑马鱼PDX模型分别接受了6.5和65ng/胚胎两种剂量的5-FU治疗。将0 dpt时的细胞数设置为基线,并归一化为1。对照组患者6号细胞从0 dpt到2 dpt增殖1.4倍。6.5ng/胚胎剂量的5-FU轻度刺激细胞增殖4%,而65ng/胚胎剂量的抑制细胞增殖40%(图6a)。对照组患者7号细胞从0 dpt到2 dpt增殖1.2倍。5-FU处理在6.5和65ng/胚胎剂量时,对细胞增殖的抑制率分别为38%和32%(图6a)。与6号患者相比,7号患者对5-FU治疗有更高的敏感性。接下来,我们选择了患者8和9来测试对更广泛的化疗药物的反应,如多西紫杉醇和阿帕替尼。多西紫杉醇和阿帕替尼的MTD分别为5 μM和0.5μM。在图6b中,对照组患者#8的细胞从0开始增殖了1.75倍dpt到2 dpt。65ng/胚胎的5-FU抑制细胞增殖23%,0.5 μM的阿帕替尼抑制18%,多西他赛5μM抑制细胞增殖8%。这些数据表明,8号患者对5-FU很敏感。对照组患者9号细胞从0 dpt到2 dpt增殖2倍。0.5 μM时阿帕替尼对细胞增殖抑制39%,65ng/胚胎时5-FU抑制14%,5μM时多西他赛抑制9%。这些数据表明,9号患者对阿帕替尼敏感。在我们的斑马鱼PDX模型中,患者#7对5-FU治疗有良好的反应。术后8个月亦无复发指征。我们的斑马鱼PDX模型与临床结果有很好的相关性。但不幸的是,我们失去了与7号患者的联系,因此我们无法获得关于复发或无复发的临床信息。患者8号和9号刚刚接受了5-FU的治疗性手术,他们的临床复发信息将被跟踪。
讨论
在这里,我们描述了一个GC的zPDX模型,它比其他动物有几个优势,如小鼠。第一,世代时间短,后代数量多,胚胎的透明性使之非侵入性成像、外部发育和胚胎的小尺寸使斑马鱼成为一种更实用和更便宜的实验室系统。第二,胚胎的透明度可以促进肿瘤细胞行为及其与宿主血管等微环境的相互作用的可视化。第三,使用较少的病人细胞数量的能力(200-800个细胞/胚胎与100万个细胞/老鼠),zPDX模型的效率药物筛选细胞解离后(细胞在斑马鱼通道0与通道3或之后在老鼠),保持一个更好的人类起源,执行中等吞吐量的力量体内药物筛选与短延迟(7天在斑马鱼模型与小鼠模型几周到数月),使快速筛选实时。然而,为了在人肿瘤样本的体内传代和扩增,建立小鼠PDX(mPDX)模型等低温保存的组织库,成年斑马鱼可以提供一种替代斑马鱼胚胎的方法。
在我们目前的研究中,我们收集了14例GC患者样本,其中9例成功建立了zPDX模型。移植成功率为64%,低于神经内分泌肿瘤zPDX模型的报道移植成功率(75%),但远高于GCmPDX模型的报道移植成功率(34%)。由于癌细胞的异质性,目前我们几乎不知道收集的样本中有什么细胞群,这可能是不同样本中移植成功的原因不同的原因。同时,技术问题可能是移植失败的另一个原因。在我们的实验中,在细胞微注射后1小时,所有死亡的胚胎,或没有统一的细胞移植和循环系统中的细胞,都被丢弃,给予微注射的成功率在40-70%之间,与Marques的研究报告相似。实际上,600-800个胚胎可以在2小时内进行微注射,这为药物筛选提供了足够的斑马鱼异种移植物。
基于5-FU的化疗是目前胃癌的一线治疗方法。一些GC细胞系对5-FU体外处理表现出不同的敏感性,包括我们研究中使用的SGC-7901和AGS细胞。令人惊讶的是,SGC-7901和AGS在斑马鱼异种移植模型中对5-FU处理的敏感性较弱,即使处理。用500μM的5-FU浸泡处理后,胚胎的存活率为100%。这些结果与Roel的报告有很大的不同,在斑马鱼异种移植模型中,5-FU浸泡降低了肿瘤生长,而浸泡48 h后胚胎存活率为50%。5-FU的报告Log P值为−0.89.Log P值小于1的化合物通常不能被斑马鱼胚胎从培养基中充分吸收,这可能导致斑马鱼胚胎浸泡后对5-FU的吸收不良。因此,我们采用显微注射法对胚胎注射5-FU。在胚胎培养基中制备5、50μM 5-FU,每个药物培养基10 nl注入斑马鱼胚胎卵黄囊,6.5、65ng/胚胎注射5-FU,肿瘤细胞生长明显消退。
我们不是通过胚胎成像和荧光密度测量,而是通过细胞解离和荧光细胞计数来定量人类细胞的生长。虽然许多研究人员使用荧光成像来定量肿瘤,但我们注意到荧光标记细胞在注射后整个胚胎以三维方式散开。因此,基于荧光密度的显微照片的测量不能准确地反映细胞的数量。此外,当细胞分裂为两个子细胞时,CM-DIi标记细胞的红色荧光密度趋于减弱,因此荧光密度不会随着细胞的增殖而增强。因此,我们在指定的时间点分离斑马鱼胚胎,并手工计数荧光标记的细胞。该方法的定量精度远高于成像定量方法。
胃癌属于一种异质性较高的癌症类型。癌症基因组图谱(TCGA)提出了一种分子分类,将GC分为四种亚型:1)eb病毒阳性肿瘤;2)微卫星不稳定肿瘤;3)基因组稳定肿瘤;4)染色体不稳定的肿瘤[45]。亚洲癌症研究小组(ACRG)也提出了胃癌的四种亚型,并将其不同的分子改变模式与疾病进展和预后联系起来。基于这些GC转化研究的惊人进展,迫切需要个性化医疗。Fior小组最近报道了建立用于结直肠治疗化疗敏感谱的zPDX模型,发现患者与化疗敏感性之间的相关性为90%。我们认为,GC的zPDX模型也可能是一个很有前途的平台,可以用于临床前药物筛选,甚至在临床中实时选择化疗药物,尽管需要完成更多的患者样本和更长时间的临床反应随访。此外,在本研究中,由于这些患者在可能没有明显疾病的证据时进行了手术和辅助5-FU治疗,其背景与使用5-FU作为主要治疗的斑马鱼研究略有不同。但这并不能降低斑马鱼对确定肿瘤敏感性的研究,从而可能预测哪些患者将从添加5-FU中获益。
结论
综上所述,本研究提示了一种新的zPDX模型,可以作为肿瘤-微环境相互作用、生物标志物发现、药物筛选等转化研究的创新平台。我们未来的更大样本量的研究将集中于研究其在GC治疗决策中的潜在效用。
基金:本项目受国家自然科学基金项目(No.81272711),江苏省高等学校重点学术项目发展项目(PAPD,JX10231801),重点医学项目江苏省人才项目、江苏省重点研发专项基金(BE2015696、BE2016614、BE2017611)、江苏省六大人才高峰项目(2016-SWYY-024)、南京科技大学本科生和研究生创新项目(201713022A;KYLX16_0624)、南京科技项目(201605023)等资助。
本文章原文Wu et al. Journal of Experimental & Clinical Cancer Research (2017) 36:160 ,
详细网址:https://link.springer.com/article/10.1186/s13046-017-0631-0


