

- 首页
- 关于我们
- 产品中心
- 斑马鱼科研服务
- 斑马鱼基因组遗传实验操作
- 斑马鱼染色及其他技术服务
- 整体斑马鱼原位杂交技术服务
- 斑马鱼免疫荧光技术服务
- 斑马鱼软骨染色技术服务
- 斑马鱼硬骨染色技术服务
- 斑马鱼血红蛋白O-dianisidine染色技术服务
- 斑马鱼中性粒细胞染色技术服务
- 斑马鱼巨噬细胞染色技术服务
- 斑马鱼活性氧(ROS)检测技术服务
- 斑马鱼破骨染色技术服务
- 斑马鱼脂质(油红O)染色技术服务
- 斑马鱼细胞凋亡染色技术服务(AO染色法)
- 斑马鱼初级造血细胞观察技术服务(初级造血细胞荧光转基因鱼)
- 斑马鱼次级造血细胞观察技术服务(次级造血细胞荧光转基因鱼)
- 斑马鱼多巴胺神经元细胞观察技术服务(多巴胺神经元细胞荧光转基因鱼)
- 斑马鱼T细胞观察技术服务(T细胞荧光转基因鱼)
- 斑马鱼B细胞观察技术服务(B细胞荧光转基因鱼)
- 斑马鱼血流速度测定技术服务
- ELISA检测斑马鱼物质含量技术服务
- 组织病理技术服务
- 斑马鱼CRISPANT突变体构建技术服务
- 斑马鱼原位杂交探针(含探针载体构建、合成、验证)
- 斑马鱼细胞凋亡染色技术服务(TUNEL染色法)
- 斑马鱼细胞增殖染色技术服务(Edu染色法)
- 斑马鱼NO染色技术服务(DAF-FM荧光探针)
- 斑马鱼脂质过氧化染色技术服务(DPPP荧光探针)
- 斑马鱼β-半乳糖苷染色技术服务
- 斑马鱼肾小球滤过率技术服务
- 斑马鱼心房心室形态观察技术服务(心脏荧光转基因鱼)
- 斑马鱼中性粒细胞观察技术服务(中性粒细胞荧光转基因鱼)
- 斑马鱼巨噬细胞观察技术服务(巨噬细胞荧光转基因鱼)
- 斑马鱼软骨细胞观察技术服务(软骨细胞荧光转基因鱼)
- 斑马鱼成骨细胞观察技术服务(成骨细胞荧光转基因鱼)
- 斑马鱼毛细胞观察技术服务(毛细胞荧光转基因鱼)
- 斑马鱼肝脏细胞观察技术服务(肝脏细胞荧光转基因鱼)
- 斑马鱼胰腺细胞观察技术服务(胰腺细胞荧光转基因鱼)
- 斑马鱼甲状腺细胞观察技术服务(甲状腺细胞荧光转基因鱼)
- 斑马鱼线粒体观察技术服务(线粒体荧光转基因鱼)
- 斑马鱼突触观察技术服务(突触荧光转基因鱼)
- 斑马鱼行为实验技术服务
- 斑马鱼毒理实验技术服务
- 斑马鱼实验操作试剂盒
- 斑马鱼检测试剂盒(补充)
- 斑马鱼基因敲除试剂盒
- 斑马鱼gRNA合成试剂盒
- 斑马鱼gRNA纯化试剂盒
- 斑马鱼基因组DNA快速提取试剂盒
- PCR产物纯化试剂盒(磁珠法)
- T7酶切试剂盒
- 斑马鱼基因组DNA精确提取试剂盒
- 斑马鱼幼鱼/组织总RNA提取试剂盒
- 斑马鱼破骨染色试剂盒
- 斑马鱼脂质(油红O)染色试剂盒
- 斑马鱼软骨染色试剂盒
- 斑马鱼硬骨染色试剂盒
- 斑马鱼组织特异性标记转基因试剂盒
- 斑马鱼miRNA功能验证转基因试剂盒
- 斑马鱼过量表达转基因试剂盒
- 斑马鱼原位杂交试剂盒
- 斑马鱼血红蛋白O-Dianisidine染色试剂盒
- 斑马鱼凋亡细胞染色试剂盒
- 斑马鱼中性粒细胞染色试剂盒
- 斑马鱼巨噬细胞染色试剂盒
- 斑马鱼活性氧(ROS)检测试剂盒
- 斑马鱼免疫组化试剂盒
- 斑马鱼临床转化应用
- 产品功效及安全性评价
- 斑马鱼实验室建设服务
- 哺乳动物科研服务(啮齿类)
- 科研课题服务
- 细胞与分子实验相关技术服务
- 天然产物的生物活性评价研究
- 其他技术服务
- 斑马鱼科研服务
- 科研相关资源
- 加入我们
原名:Zebrafsh xenograft model for studying mechanism and treatment of non-small cell lung cancer brain metastasis
杂志:Journal of Experimental & Clinical Cancer Research
影响因子: 11.3(2022)
年份:2021
通讯作者: Ming-Fang He
通讯作者单位:Institute of Translational Medicine, College of Biotechnology and Pharmaceutical Engineering, Nanjing Tech University
摘要
背景:脑转移(BM)被认为与非小细胞肺癌(NSCLC)的死亡率和不良预后有关。尽管NSCLC治疗的发展前景光明,但由于存在阻止药物渗透的血脑屏障(BBB),以及离开治疗的患者中位生存时间较短,NSCLC BM的治疗仍不乐观。在此背景下,NSCLC BM治疗需要进一步开发快速、有效的临床前模型。在这里,我们报道了一个使用斑马鱼促进NSCLC BM患者药物开发的模型系统。
方法:采用3种不同的NSCLC细胞系(H1975、A549和H1299)建立斑马鱼BM模型。对注射用胚龄和细胞数进行了优化。在斑马鱼的脑血管中观察到转移细胞,并用苏木精-伊红(HE)染色证实。然后,我们还研究了通过操纵microRNA-330-3p(miR-330-3p)表达的H1975和A549的转移潜能。最后,检测了H1975和A549对奥西替尼和吉非替尼的敏感性。
结果:该斑马鱼BM模型可以区分具有不同BM潜能的NSCLC细胞系。过表达miR330-p显著提高了A549细胞的BM潜能,而敲低miR-330-p则降低了H1975细胞的BM能力。奥西替尼和吉非替尼在斑马鱼BM模型中均有抑制效果,抑制率均高于50%。H1975细胞在体内和体外对奥西替尼的敏感性均远高于吉非替尼。
结论:我们建立了斑马鱼脑转移模型,以研究NSCLC BM的治疗机制和治疗方法。本研究为NSCLC脑转移提供了一个有用的模型,可用于研究驱动NSCLC细胞进入大脑的机制,并确定潜在的治疗方案。
关键词:斑马鱼,脑转移,异种移植物,非小细胞肺癌
前言
尽管靶向治疗和生物标志物的发展是有前途的,但非小细胞肺癌(NSCLC)仍然是癌症相关死亡的主要原因之一。大多数NSCLC相关的死亡是由于对常规治疗(手术切除、放疗、化疗或这些方法的联合治疗)有耐药性的转移,最常见的转移是脑转移(BM)。30-43% 的NSCLC患者单独发生BM,在其他地方没有转移性疾病,30%-54% 的NSCLC患者在治疗后会发生BM。NSCLC BM患者的中位生存时间为7-8个月。BM还与预后不良相关,并预示着有限的有效治疗选择。
对于多发性脑转移的NSCLC患者,全脑放疗仍是主要的方法。虽然全脑放疗目前在脑脊髓瘤中具有不可替代的地位,但其毒性缺陷,如认知能力下降和症状性放射性坏死。由于NSCLC BM的低血脑屏障(BBB)通透性和侧面缺陷,因此对NSCLC BM的化疗通常不是一种有效的方法。在NSCLC的治疗中,EGFR和间变性淋巴瘤激酶(ALK)/met原癌基因酪氨酸激酶抑制剂的成功应用强调了基于基因型的个体化靶向治疗的重要性。然而,由于广泛的分子和功能异质性,BM患者从靶向治疗中获益有限。一方面,并非所有靶向药物都具有良好的血脑屏障通透性,靶点的奇异性限制了其在多突变脑脊髓中的作用。另一方面,虽然一些具有良好血脑屏障渗透性的靶向药物,如奥西替尼,在治疗早期在BM患者中表现出良好的活性,对突变体EGFR(T790M)的获得性耐药性可以在奥西替尼治疗后进化。此外,尽管有令人鼓舞的数据,但只有少数患者对免疫治疗有反应。总的来说,无论采用何种治疗方法,NSCLC BM患者的疗效都存在着巨大的个体差异,这迫切需要一个临床前动物模型来辅助精确的药物治疗。
斑马鱼(Danio rerio)是一个强大的和基因可管理的模型,可用于研究人类恶性肿瘤。它与哺乳动物具有高度的生理和遗传相似性,非常接近于临床环境,并允许监测肿瘤的自然进程。此外,斑马鱼胚胎是透明的,可以在体内动态观察癌细胞的增殖、侵袭和转移。斑马鱼异种移植模型被用于各种癌症研究。在胃癌研究中,斑马鱼患者来源的异种移植物模型表现出临床相似的病理表型和药物敏感性。也有报道称,斑马鱼异种移植物是一种快速、高灵敏度的检测方法,可用于显示多种生物肿瘤特征和评估肿瘤对结肠直肠癌治疗的反应。由于其血脑屏障的结构和功能与人类高度相似,斑马鱼原位胶质母细胞瘤异种移植模型被用于筛选血脑屏障穿透药物。虽然有许多斑马鱼模型用于癌症转移的研究,目前还缺乏斑马鱼异种移植模型来研究脑转移,特别是NSCLC脑转移。
在此,我们利用不同的NSCLC细胞系(H1975、A549和H1299)建立了斑马鱼BM模型,并验证了其在NSCLC BM的机制研究和治疗中的可行性和可靠性。我们证明了这个斑马鱼NSCLC BM模型可以模拟人类NSCLC BM。它可能是一个有用的模型来研究驱动NSCLC细胞进入大脑的机制,并确定潜在的治疗选择。
方法
试剂
奥西替尼(Osi,纯度> 99%)和吉非替尼(Gefi,纯度> 99%),购自塞勒克化学公司(上海,中国),用DMSO溶解,获得100 mM和20 mM的库存浓度。实验前配制稀释溶液。以胚胎培养基或细胞培养基中添加0.1%的DMSO作为溶剂对照。胎牛血清(FBS)、磷酸盐生理盐水(PBS)、罗斯威尔公园纪念研究所基础培养基1640(RPMI 1640)、青霉素和链霉素购自基础培养基技术公司(上海,中国)。
细胞系和培养
人NSCLC肺癌细胞系A549、H1975、H1299,最初来自美国型培养收集,按照标准要求进行培养。人乳腺癌细胞系MDA-MB-231和MCF-7购自Procell(武汉,中国)。A549在添加10%胎牛血清和1%青霉素-链霉素的DMEM中培养。H1299和H1975在添加10%胎牛血清和1%青霉素-链霉素的RPMI 1640中培养。MDA-MB-231在添加10%胎牛血清和1%青霉素-链霉素的L15中培养。MCF-7在添加10%胎牛血清、0.01 mg/mL胰岛素和1%青霉素-链霉素的MEM中培养。所有细胞在含有5%二氧化碳的潮湿气氛中以37℃进行培养。
斑马鱼系和维护
斑马鱼和胚胎按照标准程序饲养。成鱼经历一个14小时(h) /10小时(h)的光暗循环。将3个月至2岁的成鱼杂交产生胚胎和幼虫。本研究使用了允许可视化斑马鱼的血管系统Tg(fi-1: EGFP)斑马鱼,以及野生型AB斑马鱼。胚胎和幼鱼在28℃ E3培养基中培养(5 mM氯化钠,0.17 mM氯化钾,0.33 mM氯化钙,0.33 mM硫酸镁),从受精后1天开始(dpf),添加0.2mM N-phenylthiourea(PTU;Sigma)抑制色素形成以不干扰成像。斑马鱼的研究得到了南京科技大学动物护理和使用委员会(IACUC)的批准。
体外细胞侵袭能力试验
使用跨孔培养系统(细胞培养插入物,8 μm,24孔;中国康宁)来评估细胞侵袭能力。将稀释后的基质基质与无血清培养基分散,放入37 ℃细胞培养箱中,使其凝固。细胞用无血清培养基预饥饿24 h达到一定密度,加入200 µL细胞悬液加入上室,下室加入500µL完全培养基,将平板置于细胞培养箱24 h。将下腔室底部的细胞用中性甲醛搅拌40 min,然后用PBS洗涤两次。将腔室置于0.5% 结晶紫溶液中,放置30 min,标记细胞,然后用显微镜拍照,用Image Pro Plus计数。
细胞标记
根据制造商的说明,细胞系被浓度为0.5µL/mL CM-Dil,以及浓度为8µL/mL的CM-DiO(伊利学生物科技,中国)标记。
细胞转染
在确定适当的转染浓度后,将细胞饥饿24小时,然后按照制造商的说明,用转染试剂培养24小时。转染后的细胞用qPCR进行验证。所有RNA寡核苷酸均由GenePharma(中国)提供。
斑马鱼异种移植
在每个实验中,指定发育阶段的斑马鱼胚胎用0.003%三卡因(Sigma-Aldrich,美国密苏里州)麻醉,并放置在涂有1%琼脂糖的10 cm培养皿上。将单细胞悬液配制每毫升密度为2×107个细胞,微注射至卵黄周间隙。每个胚胎会留下大约100个细胞来引起脑转移。注射后2h后选择合适的注射胚胎(hpi)。根据我们之前的报道,选择的胚胎被放置在32个℃中进行后续实验。
斑马鱼异种移植药物给药
注射后1天(dpi)斑马鱼脑转移大小相似的异种移植物随机分布在治疗组:对照E3培养基,E3奥西替尼(1µM)和E3吉非替尼(13µM),连续3天。所有给药方法均为心内注射。
实时荧光定量PCR(qPCR)
从胚胎中分离并收集脑组织,并根据制造商的说明,使用RNA提取试剂盒(伊利学生物技术)从胚胎中提取RNA。使用实时定量PCR定量miR-330-3-3p,mfsd2aa,mfsd2ab和Claudin-5。
苏木精伊红(HE)染色
在4 dpi时,患有NSCLC脑转移的胚胎在4%多聚甲醛中固定,然后脱水,石蜡包埋并切片(6-8μm)。切片用HE染色。使用生物病理显微镜(BX45-DP72,奥林巴斯,日本)获得图像。
成像
采用倒置荧光显微镜(IX71,奥林巴斯,日本)或共聚焦显微镜(LSM710,蔡司,德国)在1 dpi和4 dpi条件下监测肿瘤细胞在脑内的迁移。
统计分析
所有的统计分析均使用Image-Pro Plus 6.0和GraphPad Prism 8.0进行。所有统计分析均以平均± SEM表示。采用单因素方差分析变化的减少/增加,然后采用Dunnett多重比较检验。当P值低于0.05时,则考虑其意义。(***)表示统计学意义:P<0.005,(**)P < 0.01,(*)P < 0.05。所有实验均重复3次,独立实验至少重复3次。
结果
斑马鱼NSCLC BM异种移植模型的建立
如图所示,红色的虚线框表示斑马鱼的大脑(图1 A),红色团块代表注射位置(图1 B)。采用Tg(fli-1:EGFP)斑马鱼观察不同发育阶段(2-6 dpf)大脑血管的发育情况。斑马鱼血脑屏障的结构主要由脑血管组成。我们观察到,在4 dpf时,脑内血管密度显著增加(图1 C)。mfsd2aa和mfsd2ab表达表明(图1 D),斑马鱼的血脑屏障可能在3 dpf时开始功能发育,在4 dpf时基本发育,在5 dpf时完全发育。因此,选择了3个时间点:2dpf(BBB未发育)、3dpf(BBB正在发育)和4dpf(BBB基本发育)来评估BBB的存在是否影响了NSCLC细胞系的BM潜能。通过注射不同细胞数对斑马鱼存活率和BM影响(图1 E),选择100个作为注射细胞的数量来准确地观察和量化斑马鱼的BM。为了确定最佳注射时间,用红色荧光染料CM-DiI标记癌细胞注射到不同发育阶段(2,3,4 dpf)的斑马鱼胚胎卵周隙(PVs)中(图1 F-H),发现2 dpf作为注射时间可以更好地量化斑马鱼中NSCLC细胞系的脑转移情况(图1 I-K)。
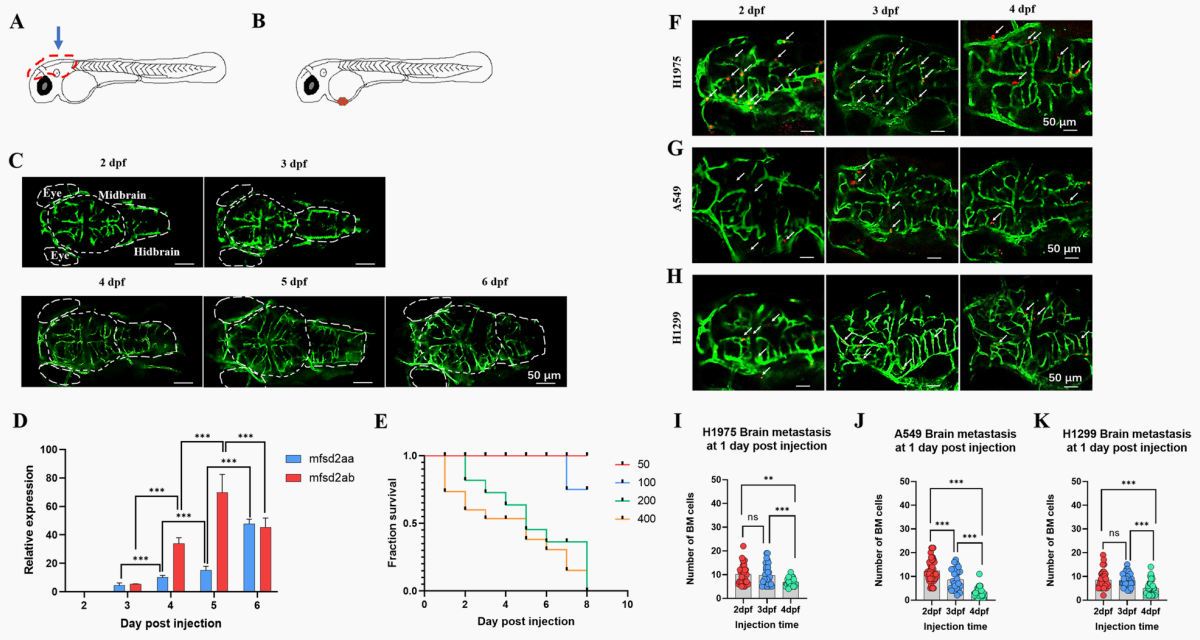
图1 斑马鱼NSCLC BM异种移植模型的建立
(A) 斑马鱼脑成像及采集示意图。从垂直视图(蓝色箭头)对斑马鱼的大脑进行成像,并切除(红色虚线框)以提取RNA。(B)示意图为2 dpf时的斑马鱼胚胎。红点表示注射到卵黄周围空间(PVs)的癌细胞。(C)Tg(fli-1:EGFP)斑马鱼(2-6 dpf)不同发育阶段的大脑图像。白色的短虚线表示斑马鱼的中脑,白色的长虚线表示斑马鱼的眼睛和后脑。(D)mfsd2aa和mfsd2ab在斑马鱼大脑中不同发育阶段的表达(2-6 dpf)。(E)2dpf斑马鱼在PVs中的生存曲线。将约50-400个H1975细胞(红色荧光)注入2 dpf斑马鱼PVs中,计算死亡数目直至8 dpi。(F-H)共涉及3种人NSCLC细胞系: H1975、A549和H1299。在不同的发育阶段,将约100个细胞注入斑马鱼的PVs中,并在1 dpi时成像斑马鱼的大脑。白色箭头表示斑马鱼脑血管中的癌细胞。(I-K)斑马鱼在1 dpi时BM细胞数量的定量分析。当P值低于0.05时,则考虑其意义。(ns)表示有统计学意义,(*)表示P < 0.05,(**)P < 0.01和(***)P < 0.001. dpf:受精后天数,dpi:注射后天数
注射4天(4 dpi)NSCLC BM斑马鱼苏木精尹红染色(HE)
将约100个H1975细胞注射到2 dpf斑马鱼的PVs中,将4 dpi的胚胎按轨迹(蓝色直线)切片(图2 A),然后进行HE染色。HE染色主要通过细胞核的形态和大小来区分正常细胞和异常细胞。H1975细胞在斑马鱼的大脑中几乎是单细胞分辨率(白色箭头)。这些个体癌细胞又长又窄,其形态与体外培养的H1975细胞相似。此外,聚集的细胞核较大,形状不均匀(白色虚线框),而正常细胞的细胞核规则且均匀。垂直切片显示斑马鱼大脑中有明显的癌细胞簇(白色虚线框)和病变(白色箭头)(图2 B)。三个斑马鱼脑横向切片显示,从表层到内膜都有H1975细胞(图2 C-E)。HE染色结果证明了NSCLC癌细胞在斑马鱼脑内可向多层转移。
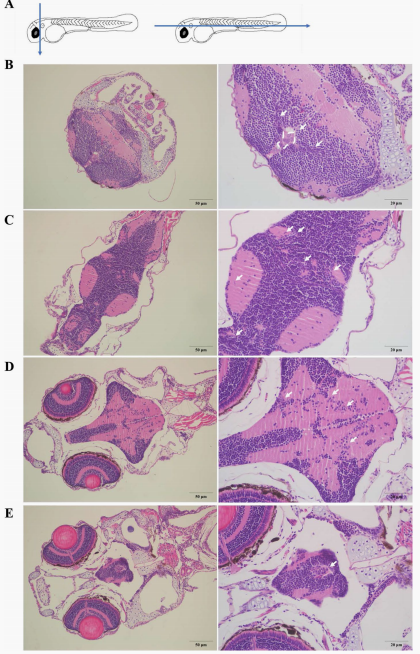
图2 注射4天(4 dpi)NSCLC BM斑马鱼苏木精尹红染色(HE)
(A)NSCLC BM的斑马鱼胚胎在4 dpi按轨迹(蓝色直线)切片。(B)垂直切片显示斑马鱼脑内有明显的癌细胞簇(白色虚线)和病变(白色箭头)。(C-E)图片显示了同一斑马鱼大脑的三个水平切片,从表层到内层。切片显示,在斑马鱼大脑的不同水平中有癌细胞(白色箭头)。
NSCLC细胞在4 dpi时在斑马鱼中脑不能增殖
前面研究显示将NSCLC癌细胞注射到2 dpf斑马鱼的PVs中,在4 dpi时,斑马鱼的大脑中数量会增加。然而,我们不能确定观察到的癌细胞是来自细胞外渗还是外渗细胞的增殖。为评估癌细胞是否能在4 dpi时增殖,将癌细胞注射到2 dpf Tg(fi-1:EGFP)斑马鱼的中脑(图3 A)。根据斑马鱼生存曲线及NSCLC细胞在卵黄囊中增殖速度选择了100个细胞作为注射细胞数(图3 B)。结果发现这些细胞系在斑马鱼中脑没有增殖(图3 H-M),和具有高侵袭性可在斑马鱼中转移和增殖阳性对照细胞MDA-MB-231相似、H1975、A549和H1299在4 dpi时有扩散趋势(图3 C-G)。因此,NSCLC癌细胞不会在4dpi内在斑马鱼的大脑中增殖,斑马鱼大脑中NSCLC细胞的增加是由循环转移而不是局部细胞增殖产生的。
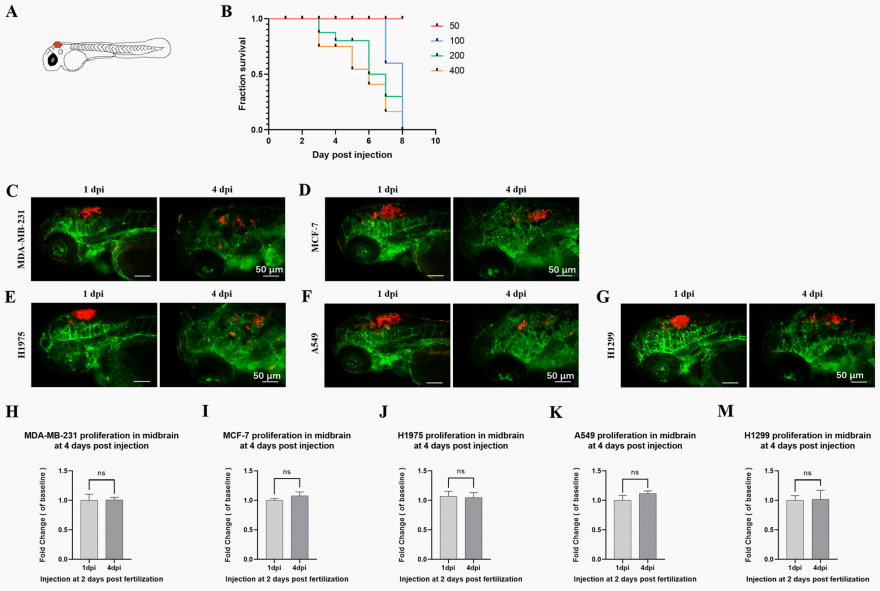
图3在4 dpi时 NSCLC细胞在斑马鱼中脑不能增殖
(A)示意图为2 dpf时的斑马鱼胚胎,红点表示被注射到斑马鱼中脑的癌细胞。(B)中脑含瘤量不同的斑马鱼生存曲线。将2 dpf Tg约50-400个H1975细胞(红色荧光)注入(fli-1:EGFP)斑马鱼的中脑,计算死亡人数至8 dpi。(C-G)涉及5种人癌细胞系:人乳腺癌细胞系MDA-MB-231(阳性对照)和MCF-7(阴性对照)、人NSCLC癌细胞株H1975、A549和H1299。在2 dpf时注射到斑马鱼中脑约100个细胞,在1 dpi和4 dpi时对斑马鱼中脑进行成像。(H-M)对斑马鱼在1 dpi和4 dpi时的中脑细胞增殖进行定量分析。将1 dpi和4 dpi的测量值除以1 dpi的平均值,确定中脑细胞的倍数变化。(ns)表示有统计学意义,(*)表示P < 0.05,(**)P < 0.01和(***)P < 0.001
斑马鱼NSCLC BM异种移植模型区分了不同细胞系的BM潜能
体外采用Transwell培养系统评估细胞侵袭能力。图像和定量分析显示,MDA-MB-231、H1975、A549和H1299在体外具有较强的侵袭能力,而MCF-7几乎没有侵袭能力(图4 A-B)。H1975的侵袭能力略强于H1299,H1975和H1299在体外的侵袭能力均强于A549。体内利用斑马鱼模型中评估了5种癌细胞系的BM的能力。在2 dpf时,将约100个细胞(红色荧光)注射到Tg(fli-1: EGFP)斑马鱼的PVs中,4 dpi时进行斑马鱼脑成像(图4 C)。以4 dpi时的BM细胞数量和1 dpi时的BM细胞数量比值计算BM势。如果BM电位大于1,则认为斑马鱼有脑转移。与体外实验结果一致,H1975在4 dpi时的BM率和BM电位均高于A549(图4 D,J)。而H1299的BM率高于A549,但其BM电位并不高于A549(图4 D,J)。通过对BM细胞的定量分析发现注射H1299的斑马鱼中有BM细胞数量减少的个体,而注射A549和MCF-7的斑马鱼中也出现了这种情况(图4 B-I)。几乎所有注射MCF-7个体的BM细胞数量都减少了,而只有部分A549个体的BM细胞数量减少。我们认为,与MCF-7相比,A549在体内具有更高的BM潜能。因此,我们认为斑马鱼BM模型可以区分不同的NSCLC细胞系的BM潜能。
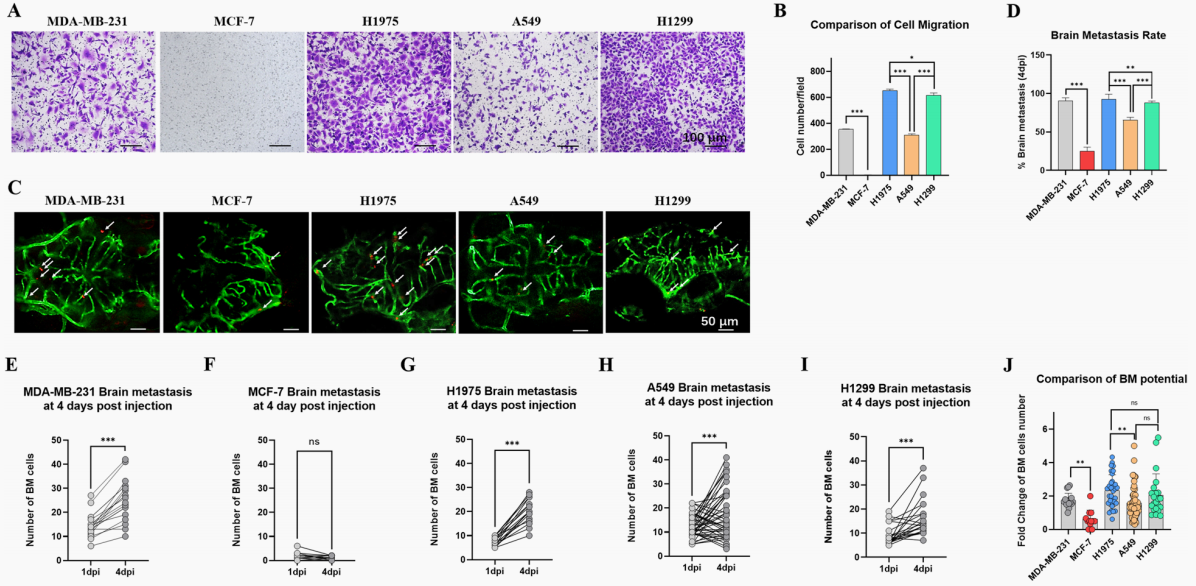
图4 斑马鱼NSCLC BM异种移植模型可以区分不同细胞系的BM潜能
(A)采用 Transwell培养系统评估体外细胞侵袭能力,其中包括5种癌细胞系: MDA-MB-231、MCF-7、H1975、A549和H1299。入侵的细胞用结晶紫(0.5%)染色,孵育24 h后成像。(B)体外入侵细胞的定量及比较。菌落使用Image Pro Plus进行定量。(C)共涉及5种癌细胞系: MDA-MB-231、MCF-7、H1975、A549和H1299。在2 dpf时,将约100个细胞(红色荧光)注射到Tg(fli-1:EGFP)斑马鱼的PVs中,在4 dpi时对斑马鱼的大脑进行成像。白色箭头表示斑马鱼脑血管中的癌细胞。(D)4 dpi时BM率定量分析。同一斑马鱼在4 dpi时的BM细胞数除以在1 dpi时的BM细胞数。这两者的比值被命名为BM势。如果BM电位大于1,则认为斑马鱼有脑转移。(E-I)在1 dpi和4 dpi时对BM细胞定量分析。用直线连接的两个点代表同一斑马鱼在1 dpi和4 dpi时的BM细胞数量。(J)细胞BM电位的定量和比较。通过将同一斑马鱼中4 dpi时的BM细胞数量除以1 dpi时的BM细胞数量来确定BM电位。(ns)表示有统计学意义,(*)表示P < 0.05,(**)P < 0.01和(***)P < 0.001
斑马鱼NSCLC BM异种移植模型同时区分了不同细胞系的BM潜能
已知斑马鱼BM模型可以区分不同的NSCLC细胞系的BM电位,为了解这种BM电位的差异是否可以同时显示出来,分别将H1975细胞用CM-DiI(红色荧光)或CM-DiO(绿色荧光)标记,然后以相同的比例混合以消除不同染料对细胞系BM电位影响,在2 dpf时共注射到(共约100个细胞)野生斑马鱼PVs中(图5 A)。在4 dpi时对斑马鱼脑成像(图5 B),并在1 dpi和4 dpi时定量测量BM细胞数量(图5 D-E)。结果显示染料对细胞系的BM电位没有影响(图5 H)。当CM-DiI标记H1975细胞和CM-DiO标记A549细胞共注射(约100个细胞)到2 dpf的斑马鱼PVs中时(图5 C),H1975表现出比A549更高的BM电位,但是和单一注射相比,H1975和A549的BM电位均降低。H1975细胞数量也高于A549细胞(图5 I)。我们推测A549的共存可能占据了H1975的转移空间,反之亦然。

图5 斑马鱼NSCLC BM异种移植模型同时区分了不同细胞系的BM潜能
(A)示意图为2 dpf时的斑马鱼胚胎。红点和绿点表示用两种不同染料标记的癌细胞共注射到斑马鱼的pv中。(B)将约50 H1975细胞(红色荧光)和50 H1975细胞(绿色荧光)共注入野生斑马鱼的PVs中,在4 dpi时对斑马鱼的大脑进行成像。白色的长虚线表示斑马鱼的大脑。(C)将约50 H1975细胞(红色荧光)和50 A549细胞(绿色荧光)共注射到野生斑马鱼的PVs中,在4 dpi时对斑马鱼的大脑进行成像。(D-G)在1 dpi和4 dpi共注射时对BM细胞的定量分析。用直线连接的两个点代表同一斑马鱼在1 dpi和4 dpi时的BM细胞数量。(H和I)斑马鱼大脑中含有两种不同染料的细胞的百分比。将1 dpi时的BM细胞数(红/绿细胞)除以BM细胞总数,测定细胞系(红/绿细胞)的百分比。(ns)表示有统计学意义,(*)表示P < 0.05,(**)P < 0.01和(***)P < 0.001
microRNA3303p(miR3303p)的表达影响了斑马鱼异种移植模式下的NSCLC BM潜能
MiRNAs在许多癌症的发展发展中起着重要的作用。有研究表明miR-330-3p表达升高可以促进体外癌细胞增殖、存活、迁移和侵袭,并可能是识别NSCLC脑转移潜在生物标志物。因此,我们使用miR-330-3p操作来验证斑马鱼BM模型。用anti-miR-330-3p抑制剂敲除m1975细胞系中miR-330-3p的表达,用过miR-330-3p mimics过表达A549细胞系中miR-330-3p。根据制造商的说明,在1 nM和50 nM之间确定了适当的转染浓度。对miRi-330-3p体外表达的定量分析表明,50 nM为合适浓度(图6 A-B)。采用Transwell培养系统评价体外转染的效果。敲除miR-330-3p表达的H1975细胞系的侵袭能力弱于原H1975细胞系(图6 C,E)。过表达miR-330-3p的A549细胞系比原表达的A549细胞系具有更强的侵袭能力(图6 D,F)。H1975,敲除miR-330-3p的H1975,A549,miR-330-3p过表达的A549参与了斑马鱼的研究。将约100个细胞注射到Tg(fli-1:EGFP)斑马鱼的PVs中,以评估体内转染的有效性。在4 dpi时对斑马鱼脑进行成像(图6G和H),在1 dpi和4 dpi时定量测量BM细胞的数量(图6I-L)。数据显示,低表达miR-330-3p的H1975细胞系的BM潜能显著降低,而过表达miR-330-3p的A549比原A549细胞系具有更高的BM潜能(图6 M-N)。

图6 microRNA-330-3p(miR-330-3p)的表达影响了斑马鱼异种移植模型中的NSCLC BM潜能
(A和B)miR-330-3p在体外的定量表达。根据说明,在1nM~50nM之间测定适当的转染浓度。(C和D)用anti-miR-330-3p抑制剂敲除m1975细胞系中miR-330-3p的表达,用过miR-330-3p minics过表达A549细胞系中miR-330-3p。采用Transwell培养系统评价体外转染的效果。入侵的细胞用结晶紫(0.5%)染色,孵育24 h后成像。(E和F)体外被入侵细胞的定量分析。使用Image Pro Plus对菌落进行定量。(G和H)miR-330-3p过表达的H1975、H1975、miR-330-3p过表达的A549和A549参与其中。将H1975,敲除miR-330-3p H1975,A549和过表达miR-330-3p A549细胞系的约100个细胞(红色荧光)注射到2 dpf的Tg(fli-1:EGFP)斑马鱼PVs中,以评估体内转染的有效性,并以4 dpi对斑马鱼的大脑进行成像。白色箭头表示斑马鱼脑血管中的癌细胞。(I-L)1dpi和4 dpi的BM细胞定量。用直线连接的两个点代表同一斑马鱼在1 dpi和4 dpi时的BM细胞数量。(M和N)转染的细胞系和原始细胞系的BM电位的定量和比较。(ns)表示有统计学意义,(*)表示P < 0.05,(**)P < 0.01和(***)P < 0.001
斑马鱼NSCLC BM异种移植模型在4天内区分出不同的化学敏感性
奥西替尼是第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFRTKIs)之一,在NSCLC中具有既定的疗效和安全性,它可以穿透血脑屏障,在脑转移患者中表现出比吉非替尼更好的疗效。采用跨孔培养系统评价奥西替尼(1µM)和吉非替尼(2µM)对体外细胞侵袭的有效性(图7 A-B)。尽管奥西替尼对H1975的细胞侵袭抑制作用强于吉非替尼,两者在A549上无明显差异(图7 C-D)。人NSCLC细胞系H1975和A549参与评估奥西替尼(1µM)和吉非替尼(13µM)在体内的有效性。约100个细胞注射到2 dpf时Tg(fli-1:EGFP)斑马鱼PVs中,有脑转移的胚胎在1 dpi心内注射奥西替尼和吉夫替尼。在4 dpi时对斑马鱼脑成像(图7 E-F),在1 dpi和4 dpi时定量测量BM细胞的数量(图7 G-H)。与体外实验结果一致,奥西替尼在体内对H1975的BM电位抑制作用强于吉非替尼的抑制作用(图7 C, G)。与体外实验不同,奥西替尼在体内对A549的BM电位的抑制作用强于吉非替尼(图7 D, H)。

图7 斑马鱼NSCLC BM异种移植模型在4天内区分了不同的化学敏感性
(A和B)NSCLC细胞系H1975和A549参与其中。采用跨孔培养系统评价奥西替尼(1µM)和吉非替尼(2µM)在体外抗细胞侵袭的有效性。入侵的细胞用结晶紫(0.5%)染色,孵育24 h后成像。(C和D)体外被入侵细胞的定量分析。菌落使用Image Pro Plus进行定量。(E和F)NSCLC细胞系H1975和A549参与其中。将Tg(fli-1:EGFP)斑马鱼胚胎在2 dpf时注射约100个细胞(红色荧光)到PVs中,并通过心内注射给予奥西替尼(1µM)和吉非替尼(13µM)。(G和H)4dpi时细胞脑转移的定量分析。将同一斑马鱼中的BM细胞数量除以1 dpi时的BM细胞数量,确定BM细胞数量的倍变化。(ns)表示有统计学意义,(*)表示P < 0.05,(**)P < 0.01和(***)P < 0.001
讨论
在NSCLC患者中,脑脊髓炎的发病率增加,预后不佳,这促进了了解脑脊髓炎的病理生理学和对这些患者测试有效的治疗策略的紧迫性。虽然NSCLC患者的治疗取得了许多进展,但BM患者的预后仍然令人沮丧。用于治疗NSCLC BM的靶向药物受到血脑屏障进入脑实质的限制,从而减少了血流速度。耐药性也是NSCLC BM的一个常见问题,特别是奥西替尼耐药后缺乏第四代药物酪氨酸激酶抑制剂。此外,肺癌脑转移的治疗时间较短,中位生存时间通常为3~8个月。在目前的情况下,有必要进行更多的机制相关研究和验证NSCLC BM的新治疗策略。
动物模型正逐渐成为癌症研究的重要辅助工具。目前癌症研究的主流动物模型是小鼠模型。然而,由于植入肿瘤和扩大菌群所需要的时间,以及它们所需要的成本,小鼠模型对于临床建议并不实用。毕竟,BM是晚期癌症中常见的一种转移灶,而小鼠模型通常需要一个月或更长的时间才能达到晚期癌症。在这里,我们采用了一种中间的方法——一种快速和可靠的斑马鱼NSCLC BM模型。
我们的模型可以很好地模拟血脑屏障和NSCLC BM之间的关系。斑马鱼的血脑屏障在结构和功能上与哺乳动物相似。在我们的研究中,2 dpf时注射的H1975、A549和H1299的BM电位明显高于4 dpf时注射的,这意味着血脑屏障的发展可能会削弱肿瘤细胞的BM潜能。我们的数据还显示,功能和结构更完整的血脑屏障对癌细胞具有更高的屏障效应,但不能完全阻断肺癌细胞的脑侵袭。虽然5 dpf的斑马鱼血脑屏障比斑马鱼血脑屏障有更多的临床价值,但出于某些原因,我们仍然选择2 dpf作为注射时间。首先,从2 dpf到6 dpf,斑马鱼的主要先天免疫细胞是巨噬细胞和中性粒细胞,它们可能在肿瘤清除过程中发挥重要作用。在我们的实验中,我们发现,当100个癌细胞在2 dpf时被移植到斑马鱼卵黄囊中时,细胞在5 dpf(3 dpi)后生长减慢。将100个癌细胞注射到2 dpf斑马鱼PVs中,也发生了同样的情况。在5 dpf(3 dpi)后,BM的增加也减慢了。我们推测,这可能是由于5 dpf后先天免疫系统的发展,并开始排斥异种移植的癌细胞。第二,PVs是斑马鱼卵黄囊周围的一个空腔,没有器官或血管PVs的上部与斑马鱼的人静脉管(通常称为居维叶管)相连,前部与心包(心包中的主动脉血管)相连。因此,PVs与斑马鱼的血管系统相连,从而促进癌细胞的转移。尽管注射到PVs中,癌细胞不仅可以转移到大脑,也可以转移到尾部。许多基于斑马鱼模型的癌症转移研究都使用PVs作为注射部位。我们观察到斑马鱼PVs在5 dpf时几乎完全消失,这将影响显微注射部位的准确性。
在确定我们的模型可以建立NSCLC BM后,我们对NSCLC BM的机制和药物敏感性进行了相关验证。毕竟,建立斑马鱼BM模型的目的是为NSCLC BM机制的研究和验证新的治疗策略提供帮助。我们验证了已报道的miR-330-3p对NSCLC BM的影响,以及EGFR靶向药物吉非替尼和奥西替尼在NSCLC BM 治疗中的应用。根据临床报道,在NSCLC-BM-+患者中,miR-330-3p的表达略有升高,而miR-330-3p在NSCLC-BM-+患者中的表达明显降低,这意味着miR-330-3p可能是BM标记物。
在大多数斑马鱼异种移植模型中,药物暴露通常是经皮吸收(浸泡)。我们最初试图通过经皮吸收给药,但这种给药方法没有区分奥西替尼和吉非替尼对NSCLC BM细胞的影响。我们推测,经皮吸收使吉非替尼可以绕过血脑屏障的存在,并直接作用于转移到斑马鱼大脑的癌细胞。从这方面来看,抗脑转移药物应该有渗入血脑屏障的能力。在我们的斑马鱼BM模型中,它需要在注射药物之前等待一个功能完整的血脑屏障。我们通过3 dpf(1 dpi)的心内注射药物,药物直接进入血液,它们必须通过血脑屏障到达中脑,并直接作用于转移到大脑的癌细胞。
在本研究中,我们发现NSCLC细胞系H1975在体内和体外对奥西替尼的敏感性均高于吉非替尼。这与临床报道一致,即在EGFR突变的NSCLC BM患者中,奥西替尼由于其更好的血脑屏障通透性和更好的疗效,比其他EGFR-TKIs表现出更大的疗效。然而,在A549中并没有出现类似的情况。虽然A549对奥西替尼和吉非替尼都敏感,但不能像H1975一样明显反映奥西替尼和吉非替尼之间的体外差异。奥西替尼是T790的靶向抑制剂,而H1975有T790M和L858R突变,而A549没有。这一确切靶点的缺失可能使奥西替尼在H1975中比在A549中更有效。吉非替尼靶向EGFR 19/21外显子突变。EGFR 19/21外显子突变常伴随着EGFR表达的增加,而A549中EGFR的表达高于H1975,这可能促进吉非替尼在A549中具有比H1975中更强的药效影响。该结果可能导致吉非替尼和奥西替尼之间的疗效差异,这只能在H1975中重现,而在A549中不能重现。总之,这证明了我们的BM模型可以区分NSCLC BM对靶向药物的化学敏感性。此外,这种差异表现得很快——仅给药三天,满足了快速的临床需求。
斑马鱼BM模型最大的缺点是肿瘤不能在斑马鱼的大脑中长期存在。斑马鱼胚胎在受精后一个月有一个完整的免疫系统。在斑马鱼中无法长时间携带肿瘤意味着在斑马鱼异种移植模型中无法研究肿瘤进化、抗性克隆的出现和疾病的整体进展。在这一点上,需要一个小鼠模型来补充它。斑马鱼NSCLC BM模型可以用于快速筛选或快速验证靶点,而小鼠BM模型可以提供实体BM肿瘤来研究肿瘤的进展和复发。
随着越来越多的研究使用斑马鱼作为患者来源的异种移植物(zPDX)的模型,斑马鱼已被证明是一种快速和准确的模型,可用于显示多种生物肿瘤特征和评估肿瘤对治疗的反应。该模型不仅可用于基础研究,也可用于临床精准医疗。为了更好地了解NSCLC的生物学和恶性过程,使用患者来源的原代培养是很重要的。虽然3D培养和生物反应器在体外表现良好,但基于体内模型的验证对于患者来源的原代培养是必不可少的。模式的选择对于保证原代培养的最大优势至关重要。我们的实验结果表明,斑马鱼模型能够很好地保留和显示NSCLC细胞系的脑转移特征,这为斑马鱼模型在原代培养中的应用奠定了基础。我们希望我们可以进一步使用我们的斑马鱼BM模型用于患者来源的异种移植物,以验证其在临床实践中的潜在应用。
结论
综上所述,我们首次建立了斑马鱼NSCLC BM模型,结果表明斑马鱼NSCLC BM模型是对细胞异质性敏感的快速、可靠的模型。我们用NSCLC细胞系进行了验证性实验,为NSCLC BM的研究提供了新的平台。我们甚至可能为临床快速筛选个性化NSCLC BM治疗提供新的可能性。
基金:本项目由江苏省先进生物制造协同创新中心(XTE1835)、中国博士后科学基金(2020M681574)、江苏省自然科学基金(BK20210546)、江苏省重点研发专项基金(BE2018758)资助。
本文章原文:Fan et al. Journal of Experimental & Clinical Cancer Research (2021) 40:371
详细网址:link.springer.com/article/10.1186/s13046-021-02173-5


